Introduction :
La sécurité biologique se définit selon l’OMS comme l’ensemble des mesures et des pratiques visant à protéger les personnes et l’environnement des conséquences liés aux risques chimiques, physiques et infectieux(1).Les anatomopathologistes sont à risque potentiellement infectieux Covid-19 en raison de l’exposition à certains échantillons de patients infectés (Covid-19+).Pour cela l’OMS recommande que tous les échantillons sélectionnés pour l’histo-cytopathologie doivent être considérés potentiellement infectieux. Elle a mis en place un protocole des prélèvements histologiques et cytologiques dans le but d’assurer la sécurité du personnel de laboratoire (2).
Les produits désinfectants usuels virucides : en respectant la concentration et le temps de contact allant de 30 s à 10 min (3).
- Hypochlorite de soude (eau de javel) à 0.1%
- Peroxyde d’hydrogène (eau oxygénée) à 0.5%
- Ethanol à 70°
- Glutaraldehyde à 2%
Circuit des prélèvements au service d’ACP pendant la période de pandémie COVID-19 :
Règles à respecter durant toutes les étapes du circuit au service d’ACP :
-Le personnel de laboratoire d’ACP doit porter un équipement de protection individuel (EPI) approprié (gants jetables, une blouse, un masque chirurgical ou FFP2…)
-L’EPI doit être retiré à la sortie du laboratoire d’ACP et les pratiques d’hygiène, y compris le lavage des mains doivent être respectées et distanciation entre le personnel du laboratoire ACP.
-Désinfection des zones de travail et des équipements après usage (4).
- La réception :
En cas de prélèvement anatomo-pathologique chez un patient suspect ou connu COVID-19, il est important d’en informer le laboratoire d’ACP avant l’envoi.
Il est préférable de fixer immédiatement dans le formol tous les prélèvements (bloc opératoire, salle d’endoscopie……..) à l’exception des examens extemporanés.
Le transport des prélèvements doit se faire dans des sacs d’échantillons étanches avec l’étiquette de l’identité du patient (5), éviter le transport via les pneumatiques.
Au laboratoire d’ACP, la réceptionniste doit :
- Eviter tous les gestes aboutissants à la formation de gouttelettes : l’ouverture des récipients ou l’agitation des échantillons
- Les surfaces externes des récipients pour échantillons doivent être décontaminées à l’aide d’un désinfectant (70% d’alcool, 0,1% d’hypochlorite)
- Le conditionnement :
- Les prélèvements tissulaires à haut risque infectieux : poumon et tractus digestif (colectomie).
- Ils doivent être conditionnés sous une enceinte de sécurité biologique niveau II sans extraire le prélèvement du flacon (Figure1).
- Injection directe du formol si tissu pulmonaire.
- Changer le formol dans le récipient.
- Il faut laisser fixer pendant 24 h au minimum(Figure2) (2)
- Les prélèvements cytologiques :
- Peuvent être fixé au formol à température ambiante en respectant une concentration suffisante si l’on veut une action rapide :
- 2ml de formol à 4% dans 8ml de liquide = 0.8% (agit en 2 min)
- 25ul de formol à 4% dans 10 ml de liquide = 0,01% (agit en 24h) (2)
- On peut choisir le milieu liquide suivi ou non d’inclusion du culot (2)

- Macroscopie :
La prévention repose sur :
- L’utilisation d’un poste de sécurité microbiologique de type II (Figure3).
- L’utilisation des moyens de protection individuelle (Figure3).
- L’hygiène rigoureuse du plan de travail et du matériel.
- La réduction et l’inactivation des effluents. (5)
- Examen extemporané :
- Il s’agit du secteur ou le risque infectieux est le plus mal maitrisé. (5)
- Pas d’examen extemporané et si nécessaire la prévention repose sur l’utilisation de moyen de protection individuelle et du poste de sécurité microbiologique. (8)
- Techniques histologiques :
- Respect des mesures d’hygiène des mains et en utilisation des moyens de protection.
- Un bloc de tissu fixé et inclus en paraffine a un faible risque infectieux. (9)
- Techniques cytologiques :
Les échantillons de cytopathologie pourraient être classés en 3 groupes :

Des règles techniques simples limitent le risque de contamination :
- Diminution de la formation et de la diffusion d’aérosols
- Ne pas aspirer de l’air à la seringue ni purger l’air.
- Utilisation de pipettes automatiques. (3)
- Techniques immuno-histochimiques et biologie moléculaire :
Un bloc de tissu fixé et inclus en paraffine à un faible risque infectieux è pas de moyen de protection supplémentaire. (9)
Conclusion :
Tous les échantillons prélevés pour des investigations en laboratoire doivent être considérés comme potentiellement infectieux et nécessite le respect du circuit des prélèvements et des mesures de protection afin de minimiser le risque de contamination chez le personnel du laboratoire d’ACP.
Référence :
1-Laboratory biosafety guidance related to coronavirus disease 2019 (COVID-19), interim guidance 2 march 2020. WHO/2019-nCoV/laboratory/2020
2-Viabilité du SARS-CoV-2 au sein des échantillons biologiques et des surfaces et précautions de prise en charge des échantillons cytologiques au laboratoire .Mise au point rédigée sous l’égide de la SFCC, 19 mars 2020.
3-Chien-Chin Chen, MD, FIAC et al. Biosafety in the Preparation and Processing of Cytology Specimens With Potential Coronavirus (COVID-19) Infection: Perspectives From Taiwan. Wiley Online Library. Published online Month 00, 2020. DOI: 10.1002/cncy.22280,24)
4-Anthony F. Henwood (2020): Coronavirus disinfection in histopathology, Journal of Histotechnology, DOI: 10.1080/01478885.2020.1734718
5-Dominique Henin et Jean-Francois Michiels. Gestion d’une structure ACP – Recommandations et reglementations – Partie 2. AFAQAP 2013.www.afaqap.org
6-Guidance COVID-19: safehandling and processing for samplesin laboratories. Public healthEngland
7-MattiaBarbareschi, Valeria Ascoli, EmanuelaBonoldi et al.Biosafety in surgical pathology in the era of SARS-Cov2 pandemia. A statement of the Italian Society of Surgical Pathology and Cytology. PATHOLOGICA Epub 2020 Apr 1. DOI: 10.32074/1591-951X-14-20.
8-Esther Diana Rossi, MD, PhD, MIAC et al.Cytologic and Histologic Samples From Patients Infected by the Novel Coronavirus 2019 SARS-CoV-2: An Italian Institutional Experience Focusing on Biosafety Procedures.Published online April 7, 2020 in Wiley Online Library. DOI: 10.1002/cncy.22281, wileyonlinelibrary.com
9-Anthony F. Henwood. Coronavirus disinfection in histopathology.JOURNAL OF HISTOTECHNOLOGY. 2020. DOI:10.1080/01478885.2020.1734718
Pendant cette pandémie de Covid-19, nous sommes amenés à prendre en charge des pièces opératoires pour le diagnostic du cancer provenant de patients dont certains peuvent être porteurs du virus nCov-19. Les personnes ayant un cancer sont immunodéprimées et sont susceptibles de développer des complications lors de l’infection au Covid19.Des lésions histologiques intéressant plusieurs organes sont retrouvées chez les malades atteints du Covid-19. Ces lésions ont été décrites grâce à des autopsies réalisées chez des patients décédées soit d’une infection Covid-19 ou d’une autre cause inconnue.
1-Atteinte pulmonaire
- Examen macroscopique
Les lésions macroscopiques pulmonaires retrouvées à l’autopsie sont une pleurésie bilatérale, un œdème pulmonaire avec une augmentation du poids du poumon. La cavité trachéale contient des dépôts myxoides. Un épanchement péricardique minime à modéré a été reporté(1,2).
- Examen microscopique
Sur le plan microscopique, le dommage alvéolaire diffus est la principale lésion histologique pulmonaire dominée par une destruction alvéolaire de degré variable (3,4).
- Au stade précoce, on note des lésions non spécifiques similaires aux lésions de dommage alvéolaire diffus notées dans les SDRA notamment :
- Les alvéoles sont dilatées et comblés par un matériel exsudatif fibromyxoide.
- Un épaississement des cloisons interalvéolaires par un œdème et un infiltrat inflammatoire essentiellement mononucléé avec des membranes hyalines éosinophiles recouvrant les alvéoles (4-6).
- Une congestion vasculaire, une extravasation des hématies avec l’apparition des microthrombi(1, 3, 4, 6 et 7).
- Les pneumocytesde type II sont hyperplasiques, desquamés en intra alvéolaires. Ces derniers peuvent être d’allure atypique et multinucléés avec un cytoplasme granulaire éosinophile(1, 5,8 et 9).
- Les inclusions virales ne sont pas généralement retrouvées (5).
- A un stade avancé, on note l’installation d’une fibrose pulmonaire (1,6).
- Techniques complémentaires
La mise en évidence du virus en intracellulaire peut se faire par plusieurs techniques. La RT-PCR et par microscopie électronique, sont les deux techniques qui ont une sensibilité plus élevée (3). L’immunohistochimie utilisant l’anticorps anti-ncov19, l’hybridation in situ et immunofluorescence peuvent aussi identifier le virus au niveau des cellules épithéliales et des macrophages infectés mais avec une sensibilité moindre (3).
2-Lésions extra-pulmonaires
Des lésions extra-pulmonaires ont été rapportées chez des patients mais ne sont pas spécifiques :
- Au niveau hépatique, on note une stéatose microvacuolaire, une nécrose focale et un infiltrat inflammatoire non spécifique essentiellement mononucléé (1, 3,4 et 7).
- Au niveau cardiaque, l’hypertrophie cardiomyocytaire domine le tableau avec une dégénérescence et nécrose cardiomyocytaire associées à une légère hyperémie interstitielle minime (3,4).
- Au niveau du système immunitaire, on a une réduction du volume de la rate, une dégénérescence, une nécrose, une lymphopénie également retrouvée au niveau des ganglions lymphatiques et du tissu lymphoïde muqueux intestinal(4).
Au niveau rénal, on retrouve une lésion tubulaire aiguë diffuse avec une lumière tubulaire élargie, un épithélium tubulaire aplati et un œdème interstitiel. Parfois des signes de coagulation intravasculaire disséminée sont retrouvés avec de petits thrombus de fibrine dans les capillaires glomérulaires (4).
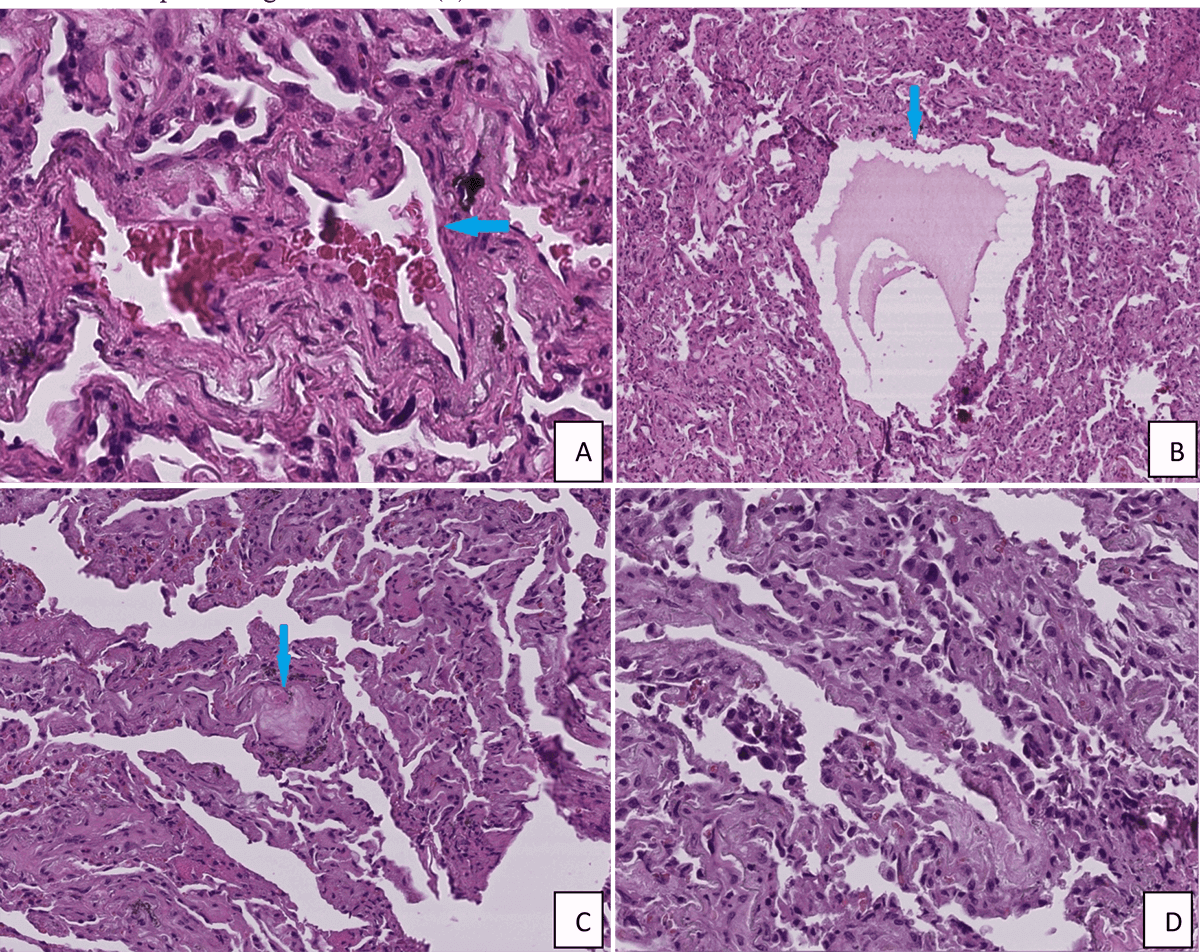
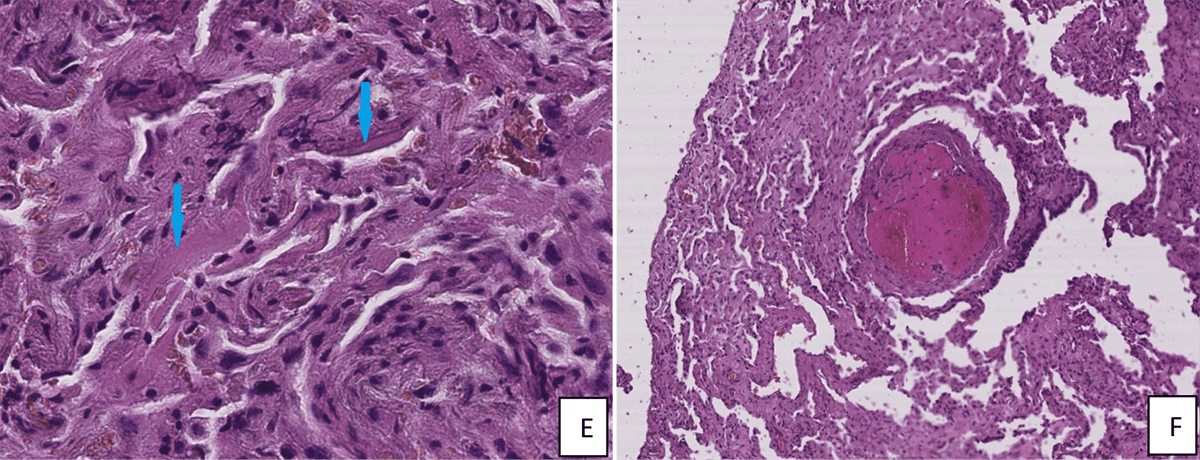
Image1 : Lésions histologiques pulmonaires d’un patient COVD-19+ hospitalisé en réanimation au CHU Mohammed VI de Marrakech (Image : LEICA SCN400). A : exsudat et hémorragie alvéolaire (HEx40). B : exsudat protéique et fibrine intra alvéolaire (flèche) avec épaississement des cloisons inter-alvéolaires (HEx10). C : Globule protéique intra alvéolaire (HEx20). D : Desquamation et hyperplasie des pneumocytes II (HEx40). E : Membrane hyaline (HEx40). F : Thrombus vasculaire (HEx10)
Référence :
1- Hanley B, Lucas SB, Youd E, Swift B, Osborn M. Autopsy in suspected COVID-19 cases. J Clin Pathol. 2020 May;73(5):239-242. doi: 10.1136/jclinpath-2020-206522.
2-Liu Q, Wang RS, Qu GQ, Wang YY, Liu P, Zhu YZ, Fei G, Ren L, Zhou YW, Liu L. Gross examination report of a COVID-19 death autopsy. Fa Yi Xue Za Zhi. 2020 Feb;36(1):21-23.
3- Zhang T, Sun LX, Feng RE. [Comparison of clinical and pathological features between severe acute respiratory syndrome and coronavirus disease 2019]. Zhonghua Jie He He Hu Xi Za Zhi. 2020 Apr 3;43(0):E040. doi: 10.3760/cma.j.cn112147-20200311-00312.
4- Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, Deigendesch N, Frank S,
Turek D, Willi N, Pargger H, Bassetti S, Leuppi JD, Cathomas G, Tolnay M, Mertz KD, Tzankov A. Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology. 2020 May 4.
doi: 10.1111/his.14134.
5- Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, Liu S, Zhao P, Liu H, Zhu L, Tai Y, Bai C, Gao T, Song J, Xia P, Dong J, Zhao J, Wang FS. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020 Apr;8(4):420-422. doi: 10.1016/S2213-2600(20)30076-X. Epub 2020
6- Chen J. [How to understand the histopathology of SARS and coronavirus disease-19 (COVID-19) associated with acute respiratory distress syndrome]. Zhonghua Bing Li Xue Za Zhi. 2020 Apr 8;49(4):289-290.
7-Lacy JM, Brooks EG, Akers J, et al. COVID-19: POSTMORTEM DIAGNOSTIC AND BIOSAFETY CONSIDERATIONS [published online ahead of print, 2020 Apr 24]. Am J Forensic Med Pathol. 2020;10.1097/PAF.0000000000000567.
8- Tian S, Hu W, Niu L, Liu H, Xu H, Xiao SY. Pulmonary Pathology of Early-Phase 2019 Novel Coronavirus (COVID-19) Pneumonia in Two Patients With Lung Cancer. J Thorac Oncol. 2020 May;15(5):700-704. 9- Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID-19 Autopsies, Oklahoma, USA. Am J Clin Pathol. 2020 May 5;153(6):725-733.
PARTENAIRES